本文刊载于《集成技术》2022年第3期“新能源新材料专栏”
司韶康1,2 张 蕾 1,3* 温佳鑫3 于淑会1 曹秀华4 付振晓4 孙 蓉 1
1 中国科学院深圳先进技术研究院 深圳先进电子材料国际创新研究院 深圳
2 中国科学技术大学纳米科学技术学院 苏州
3 南方科技大学前沿与交叉科学研究院 深圳
4 广东风华高新科技股份有限公司先进材料和电子元器件国家重点实验室 肇庆
引用格式: 司韶康, 张蕾, 温佳鑫, 等. 高四方性超细 BaTiO3 纳米粉体的制备与性能研究 [J]. 集成技术, 2022, 11(3): 108-120.
Si SK, Zhang L, Wen JX, et al. Fabrication and properties of ultra-fine BaTiO3 particles with high tetragonality [J]. Journal of Integration Technology, 2022, 11(3): 108-120.
摘要
高四方性的 BaTiO3 超细粉体是下一代多层陶瓷电容器的关键材料。该文探究了砂磨介质尺寸和原料 TiO2 晶相对反应物活性、产物介电性能的影响,并利用砂磨固相法成功合成了高四方性 BaTiO3 超细粉体。分析场发射扫描电子显微镜照片和 X 射线光电子能谱发现,细砂磨介质粉碎原料的效率更高,机械活化作用更强。Raman 光谱和 X 射线衍射图谱显示,在高能砂磨过程中,TiO2 由锐钛矿相先后转变为 TiO2-II 相、金红石相。分析微商热重曲线和 X 射线衍射,结果表明,砂磨介质更能有效降低反应温度和抑制 Ba2TiO4 的生成。此外,高分辨透射电子显微镜图像揭示了 BaTiO3 的形成是 Ba2+ 向 TiO2 晶格扩散的过程。该文相关实验结果表明,利用直径为 0.1mm 的 ZrO2 磨球对锐钛矿相 TiO2 和 BaCO3 混合物砂磨 4 h,并在 1100 °C 煅烧 3 h 后,获得了平均粒径为 186 nm、四方性为 1.0092 且分散性良好的 BaTiO3 粉体,该粉体在1250 °C 烧结的陶瓷相对密度为 96.11%,居里点(137.8 °C)的介电常数峰值为 8 677。
1 引 言
电子信息技术的突飞猛进,加快了电子元器件升级换代的速度。高性能电子陶瓷材料及无源电子元件是电子产品重要的实体,在信息产业中的地位不亚于钢铁在传统工业中的地位,其发展具有重要的战略意义。片式多层陶瓷电容器(Multi-layers Ceramic Capacitors,MLCCs)是一种新型、微型化、片式化的高精度电容器,是片式容阻感元件中用量最大、发展最迅速的核心元件[1-2]。近年来,随着电子设备及其元器件的小型化、高可靠性、薄型化和低成本化,介质材料的晶粒尺寸不断向纳米级别发展。对 MLCCs 而言,实现高容量、小型化、薄层化和高可靠性等性能要求的基础是减小基料钛酸钡(BaTiO3,BT)的粒径尺寸,即粉体超细化。为实现MLCCs的这些性能需求,基料 BT 的晶粒尺寸需要控制在 200 nm 以下。目前,超细 BT 的合成方法包括水热法[3-5]、固相法[6-9]、溶胶- 凝胶法[10-12]、熔盐法[13 - 17]等。其中,水热法和固相法是工业中常用的两种工艺。但是,水热法合成 BT 的步骤复杂、成本高、废液处理复杂,产品易存在羟基缺陷,且该方法的合成条件控制苛刻,技术壁垒高。固相法则以其成本低、工艺简单、合成的 BT 粉体缺陷少[18-20]、结晶度高的优势成为工业中最常用的工艺,但传统固相法由于较高的煅烧温度(>1000 °C)常导致 BT 粉体的粗晶化和团聚化。使用超细的原料粉体虽然可以降低煅烧温度[21-25],避免粗晶化和团聚化,但同时带来了成本增加的问题,因此,工业上急需一种经济实用的生产超细原料粉体的手段。有研究发现,砂磨工艺是一种获得超细粉体的有效方法[26-28]。本文采用砂磨工艺,通过研究不同直径(0.1 mm 和 0.3 mm)的 ZrO2 砂磨介质和不同晶型 TiO2(锐钛矿相和金红石相)对煅烧温度及 BT 性能的影响,确定了砂磨固相合成超细 BT 粉体的最优工艺,同时对其反应机理进行了探究。
2 实验方法
2.1 样品制备
本研究中使用的原料为BaCO3 (比表面积 1.37 m2/g,纯度99.8%,阿拉丁试剂(上海)有限公司)、锐钛矿相TiO2(比表面积8.7m2/g,纯度 99.0%,阿拉丁试剂(上海)有限公司)和金红石相 TiO2(比表面积 10.9 m2/g,纯度 99.0%,上海麦克林生化科技有限公司)。以去离子水为溶剂,按照等摩尔比将 BaCO3 、TiO2 混合搅拌均匀后进行砂磨。砂磨介质为ZrO2 球,直径分别为 0.1 mm 和 0.3 mm。将利用砂磨机(型号 NT-V1,东莞市琅菱机械有限公司)高速砂磨 4 h 后的浆料进行干燥处理,得到的混合粉体记作样品 S1、S2、S3 和 S4。其中,S1、S2 使用的是直径为 0.3 mm 的 ZrO2 磨球,S3、S4 使用的是直径为 0.1 mm 的 ZrO2 磨球;S1、S3 使用的是锐钛矿相TiO2,S2、S4 使用的是金红石相TiO2,具体配料见表 1。将 S1、S2、S3 和 S4 于 1100 °C 煅烧 3 h 后,加入一定量的聚乙烯醇(Polyvinyl Alcohol,PVA )并压制成圆片形生坯(直径为 5 mm,厚度为 2 mm),生坯在空气气氛中分别于 1250 °C、1300 °C、1350 °C 烧结 2 h 后可得到纯相 BT 陶瓷片,用于测试介电性能。
2.2 样品表征
原料粉体的比表面积通过比表面积及微孔分析仪(型号 ASAP2020,麦克默瑞提克(上海)仪器有限公司)进行测量。粉体及陶瓷的形貌使用场发射扫描电子显微镜(型号 NOVA NANOSEM 450 ,赛默飞世尔科技有限公司,美国)观察,并利用 ImageJ 软件对形貌照片进行统计,从而得到粉体颗粒的平均粒径和陶瓷平均晶粒尺寸(DA.V.)。样品价电子结合能使用 X 射线光电子能谱(型号 ESCALAB 250Xi,赛默飞世尔科技有限公司,美国)进行表征。TiO2砂磨前后的相转变通过室温 Raman 光谱(型号 LabRAM HR Evolution,堀场仪器(上海)有限公司)进行表征,测试时使用的激光光源波长为 532 nm。粉体的晶体结构通过 X 射线衍射仪(型号 Smartlab SE,日本理学株式会社,日本)确定,使用 JADE 软件计算 BaTiO3 的晶格参数(a 和 c)。使用热重分析仪(型号 Q-600,梅特勒-托利多集团,瑞士)在 100 mL/min 高纯干空气吹扫下,将砂磨后的样品以 10 °C/min 的速度从 25 °C升至 1 250 °C,记录升温过程中的重量变化。样品的微观结构采用高分辨场发射透射电子显微镜(型号 FEI-Talos F200X,赛默飞世尔科技有限公司,美国)进行表征。陶瓷的密度利用阿基米德排水法进行计算。介电性能使用阻抗分析仪(型号 Agilent E4980A,安捷伦科技有限公司,美国)进行测试,以 3 °C/min 的速度从室温升至 200 °C,使用频率为 1 kHz 的 1V 交流电压测试其电容,然后根据平板电容模型换算出介电常数。
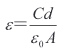
其中,d 为陶瓷片的厚度;C 为电容;ε0为真空介电常数;A 为陶瓷片的横截面积。
3 结果与讨论
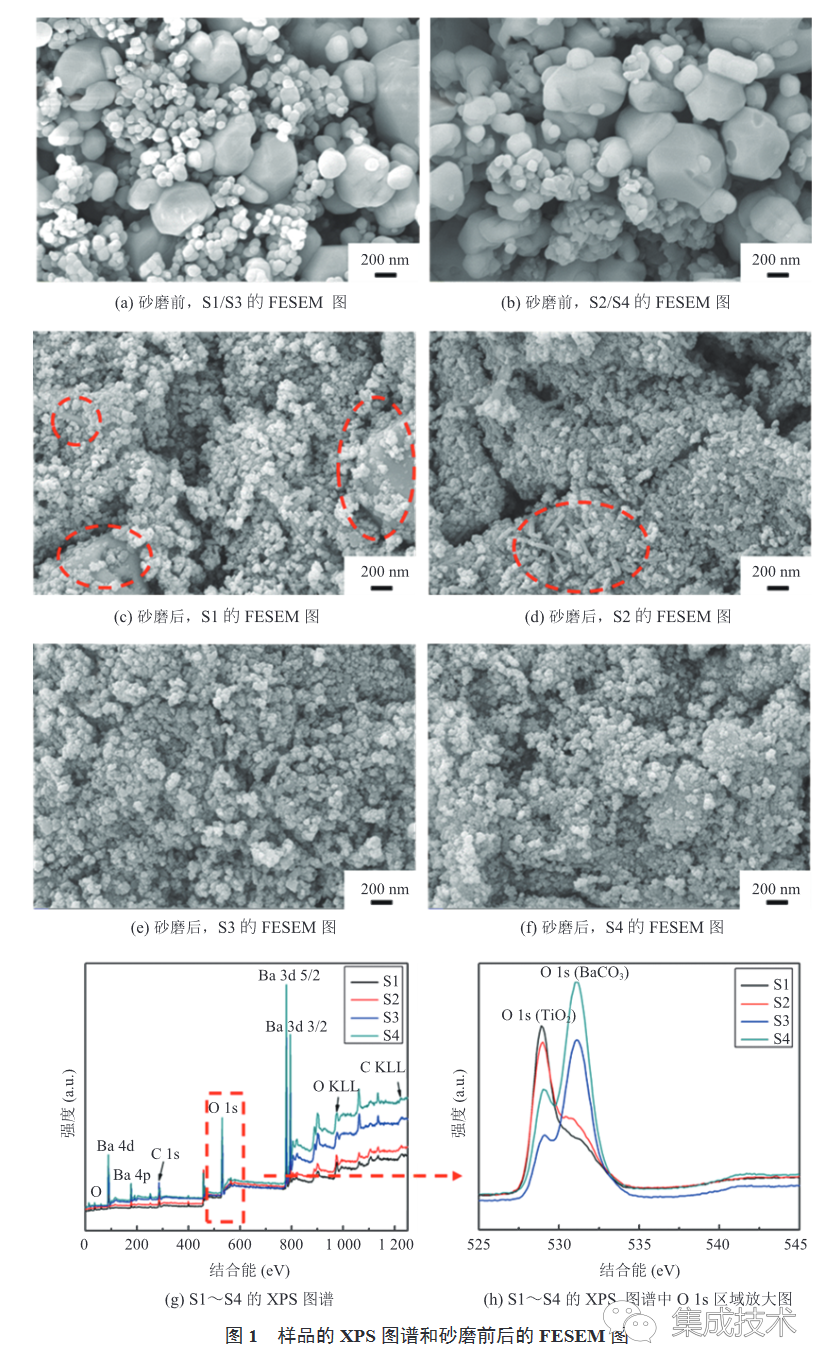
1(a)~(f)为 TiO2与 BaCO3 混合物砂磨前后的场发射扫描电子显微镜(Field Emission Scanning Electron Microscope,FESEM)图像。由图可知,砂磨前混合物颗粒尺寸相差较大,小颗粒团聚明显;砂磨 4 h 后,混合物的粒径显著减小,相对均匀。与 S3、S4 相比,S1 和 S2 的粒径尺寸更大、团聚更多,且有棒状颗粒。这可能是由于较大直径(0.3 mm)的ZrO2 砂磨介质在砂磨过程中提供的剪切和碰撞频率较小,导致其对混合物的砂磨效果较差。为了进一步分析砂磨介质对样品砂磨效果的影响,对样品 S1~S4 的 X 射线光电子能谱(X-ray Photoelectron Spectroscopy,XPS)进行测试,测试结果如图 1(g)~(h)所示。图 1(h)中两个 O 1s 峰位对应的结合能标志着TiO2 中 Ti—O 键和 BaCO3 中 Ba—O 键的结合强度[29]。由图 1(h)可知,S3 和 S4 中 O 1s(BaCO3)的相对强度较 S1 和 S2 有了明显提升,由于 XPS 的穿透深度有限,仅能测量物质表面层,所以 S3 和 S4 中 BaCO3 的信号更强意味着 S3 和 S4 中BaCO3 暴露的表面积更多,这表明与 S1 和 S2 相比,S3 和 S4 的 BaCO3 细化程度更高。由表 1 可得,S3 和 S4 的 O 1s 结合能差值(ΔBE)小于 S1 和 S2,说明 S3 和 S4 中 O 原子的化学状态更接近,反应物活化性能更高。因此,较小尺寸砂磨介质的机械活化作用更强。
为了验证砂磨带来的机械活化作用对TiO2晶型转变的影响,本实验以去离子水为分散介质,利用直径为 0.1 mm 的ZrO2 砂磨介质对锐钛矿相 TiO2 和金红石相 TiO2砂磨 4 h,TiO2砂磨前后的室温 Raman 光谱如图 2(a)~(b)所示。
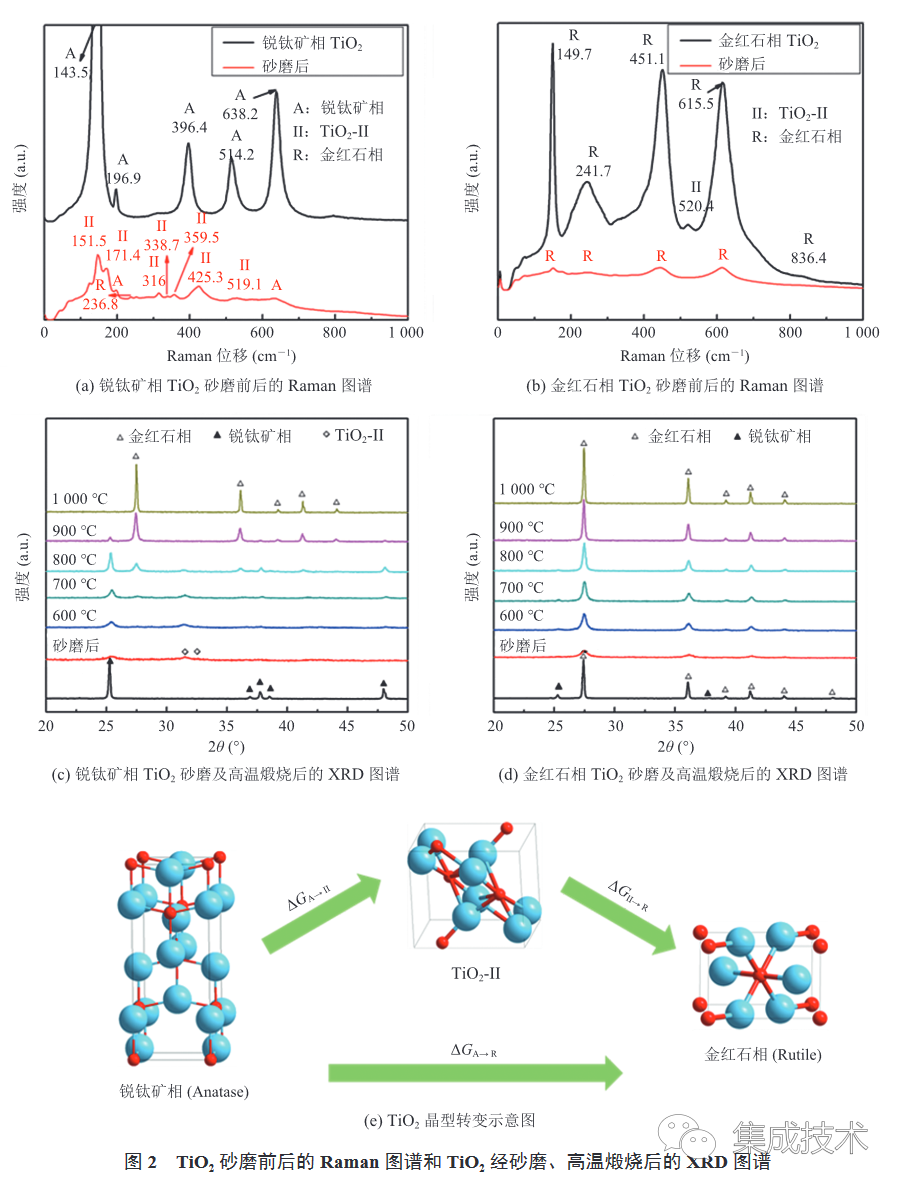
图 2(a)为锐钛矿相TiO2砂磨前后的 Raman 图谱,由图可知,TiO2砂磨前呈现出典型的锐钛矿相特征峰[30],分别为 143.5 cm-1(Eg)、196.9 cm-1(Eg)、396.4cm-1 (B1g)、514 . 2cm-1 (A1g+B1g)、638.2cm-1(Eg);砂磨后则增加了TiO2-II 相(TiO2的一种高压稳定相,结构同-PbO2,属于正交晶系,Pbcn 空间群,铌铁矿型结构)特征峰[31],分别为 151.5 cm-1(B3g)、171.4cm-1(Ag)、316 cm-1(B1g)、338.7 cm-1(B2g)、359.5 cm-1(B2g)、425.3 cm-1(Ag)、519.1 cm-1(B2g),此外,还增加了金红石相TiO2的特征峰:236.8cm-1(Eg)[32],即砂磨后的 Raman 图谱呈现出锐钛矿相、TiO2-II 、金红石相三相共存的现象。这一结果与 Ashiri 组[33]报道的锐钛矿相TiO2经 10 h 砂磨后,将完全转变为金红石相的结论不一致。原因可能是本实验的砂磨时间较短,不足以使TiO2 由锐钛矿相完全转变成金红石相,从而得到了TiO2 的三相混合物。图 2(b)为金红石相 TiO2砂磨前后的 Raman 图谱,由图可知,TiO2 砂磨前呈现出典型的金红石相及 TiO2-II 相特征峰,砂磨后则完全呈现出金红石相特征峰。进一步对不同晶型TiO2砂磨后的产物进行了高温煅烧,煅烧产物的 X 射线衍射(X-ray Diffraction,XRD)图谱如图 2(c)~(d)所示。从 600 °C 升至 1000 °C 过程中,TiO2(锐钛矿相)砂磨后的产物由于同时包含锐钛矿相、TiO2-II 相和金红石相,需要吸收较多能量进行相转变,故当温度达到 1000 °C时,TiO2(锐钛矿相)才完全转变为TiO2(金红石相)。此外,两种不同相的 TiO2经过砂磨后,衍射峰变宽,峰强降低,这是由于砂磨给物料输入了巨大能量,使得原料晶格发生畸变,因此衍射峰变宽,同时晶格焓降低,反应活性升高,从而降低了 BaCO3 与TiO2的固相反应温度[34]。通过以上实验结果可知,本研究中锐钛矿相TiO2经过短时间砂磨或是高温煅烧都会产生锐钛矿相(Anatase)→TiO2-II 相→金红石相(Rutile)的相转变(如图 2(e)所示)。这一相变顺序是由于 TiO2-II 相、金红石相、锐钛矿相之间的相变吉布斯自由能大小满足 ΔGA→II<ΔGII→R<ΔGA→R[35]。
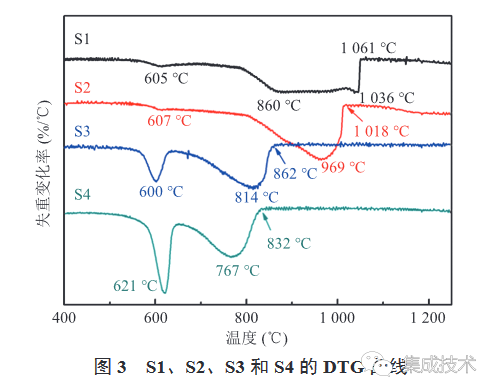
为了明确合成 BaTiO3 的反应温度,对样品 S1~S4 进行了热重分析。图 3 热重分析的 DTG 曲线中,600~621 °C 的第一个失重峰对应的是 BaCO3 与TiO2 一步生成 BaTiO3 的过程,即反应(1);760~860°C 的失重峰对应的是 BaCO3 分解后与TiO2 形成 BaTiO3 的过程,即反应(2)、(3)。通过对图 3 中 S1~S4 的 DTG 曲线综合分析可知,随着砂磨介质 ZrO2尺寸的减小,第二个失重峰的位置逐渐向低温区偏移,这表明较小尺寸的砂磨介质更利于降低 BaCO3 与TiO2 的固相反应温度。同时,S4 的第一个失重峰强度比 S3 的更大,说明 S4 中反应(1)的占比更多。S4 中反应(1)进行得更充分可能是因为 S4 粒子的表面能更高。S3 吸收的砂磨能量中有一部分用于TiO2 从锐钛矿相转变为金红石相,S4 吸收的砂磨能量则全部转化成表面能,因此,S4 粒子的表面能更高,更容易在低温段反应。此外,图 3 中 S1 除了 860 °C 的峰,还有一个 1036 °C 的峰——BaCO3 的热解峰,由于 S1 混料不够充分,少量 BaCO3 接触不到 TiO2,固相反应后处于被 BaTiO3 包夹、隔离空气的状态,这一状态下热分解的温度有较大提升,高达 1000 °C。
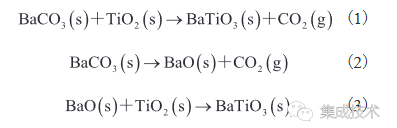
根据图 3 的 DTG 曲线,将样品在 600~1 100 °C中分别煅烧 3 h,煅烧产物的 XRD 图谱如图 4(a)~(d)所示。由图 4(a)~(d)可知,当煅烧温度为 600 °C 时,产物中含有 BaCO3、TiO2 和 BaTiO3 3 种相。其中,S3 和 S4 的 BaCO3 相衍射峰比 S1 和 S2 的要弱,表明 S3 和 S4 中 BaCO3 的转化率较高,这与图 3 中 S3 和 S4 在 600 °C、621 °C 的第一个失重峰面积比 S1、S2 大相印证。当煅烧温度升至 900 °C 时,S1 和 S2 开始生成 BaTiO3 纯相,但仍存在少量 Ba2TiO4 相;而煅烧温度升至 800 °C 时,S3 和 S4 中 BaCO3 和 TiO2相衍射峰已消失,仅存 BaTiO3 相。据 Fujikawa 等[36]的研究结果可知,当 BaCO3 过量,且煅烧温度高于 850 °C 时,会得到副产物 Ba2TiO4。而本研究中,较粗的砂磨介质使 S1 和 S2 混合的均匀性较差,导致 BaCO3 局部过量产生Ba2TiO4 。因此,使用较细的砂磨介质可有效降低固相反应温度防止Ba2TiO4副产物的生成。该结论与 Buscaglia 等[37]和 Yanagawa 等[29]的研究结果一致。
为了深入探究 BaTiO3 的形成机理,根据 XRD 图谱,本实验对 S4 在 700 °C 和 900 °C 煅烧合成 BaTiO3的产物用高分辨透射电子显微镜(High Resolution Transmission Eectron Microscopy,HRTEM)进行观察和分析。
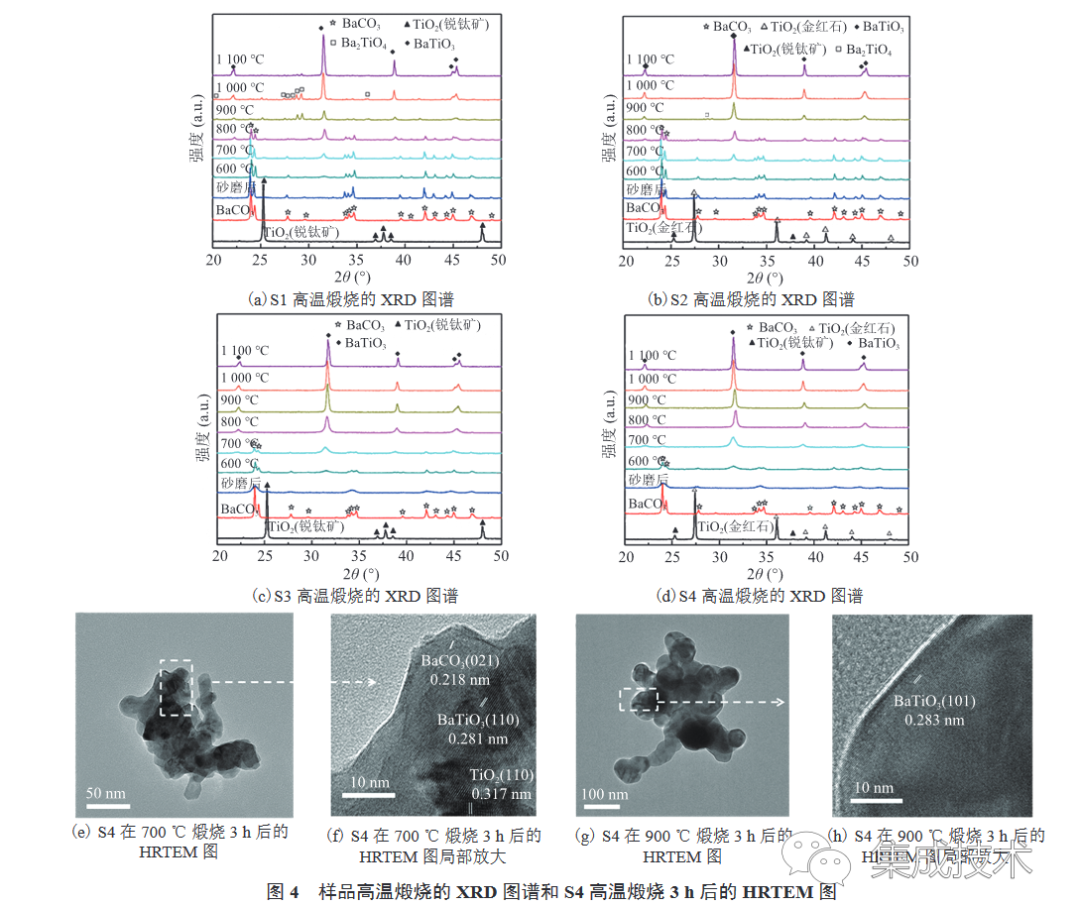
由图 4 (e)~(f)可知,当煅烧温度为 700 °C 时,S4 呈现出 TiO2/BaTiO3/BaCO3 的三层结构;当煅烧温度升至 900 °C 时,S4 则呈现出BaTiO3 的晶格结构。这一结果与 XRD 图谱相互印证,同时进一步证明了 BaCO3 与TiO2反应合成 BaTiO3 的过程,是 Ba2+、O2- 向 TiO2 晶格扩散的过程[38]。本研究中利用砂磨工艺减小了 BaCO3 与TiO2原料的粒径,极大地增加了二者的反应面积,缩短了 Ba2+→TiO2扩散的路径,有效抑制了副产物 Ba2TiO4 的形成,同时降低了BaTiO3的合成温度。
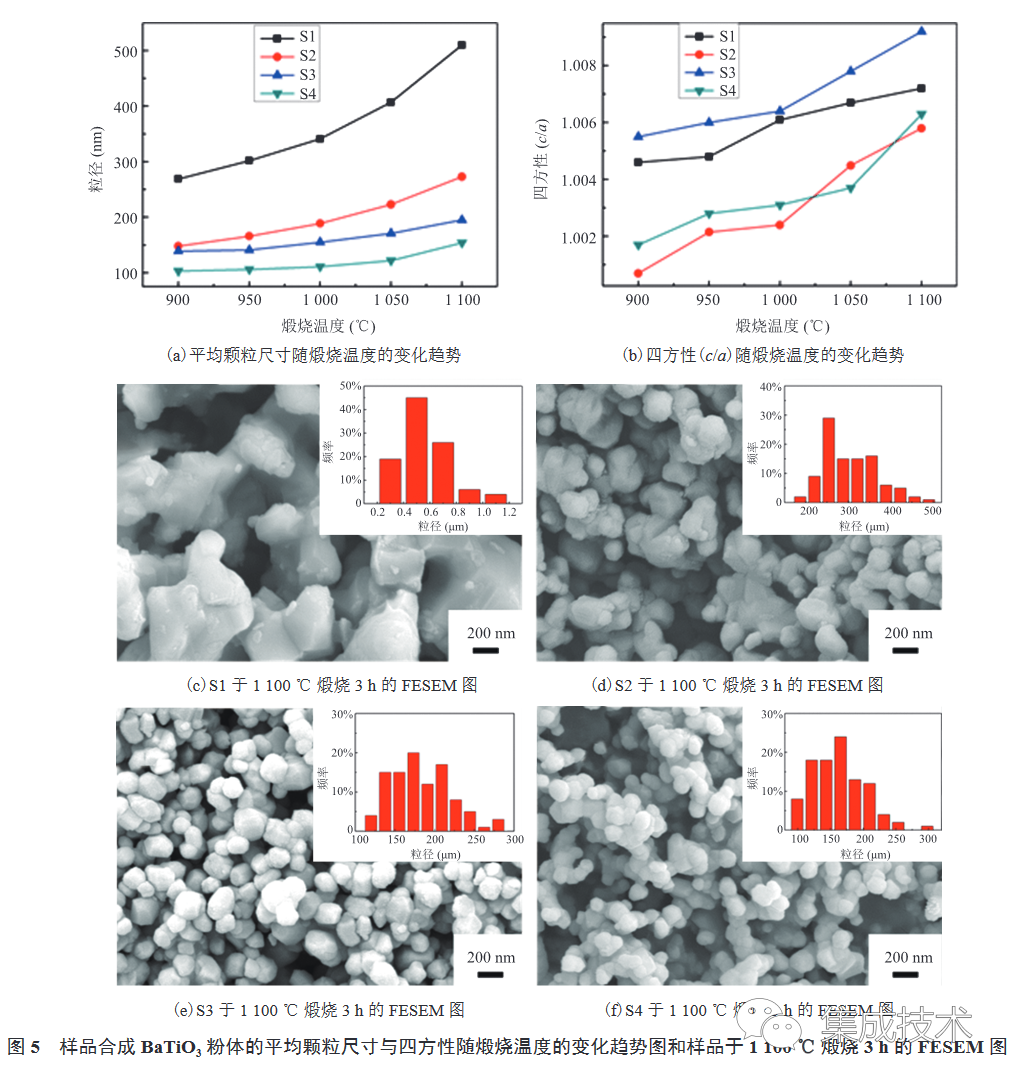
图 5(a)~(b)为 S1~S4 合成的BaTiO3 粉体平均颗粒尺寸和四方性(c/a)随煅烧温度(900~1 100 °C)的变化图。由图可知,BaTiO3的平均颗粒尺寸和四方性均会随着煅烧温度的升高而增大。一般来说,BaTiO3 的四方性与颗粒尺寸呈正相关[39]。但在本研究中,当煅烧温度相同时,S1 和 S2 的平均颗粒尺寸大于 S3 和 S4,且 S4 的平均颗粒尺寸最小;但 S3 和 S1 的四方性大于 S4 和 S2,且 S2 的四方性最小。可能是因为与金红石相TiO2相比,S1 和 S3 使用的锐钛矿相的晶胞密度较低,离子排列较为疏松,晶格间隙大,有利于 Ba2+ 扩散至TiO2 中,从而提高其四方性;而 S2 和 S4 中的金红石相TiO2的结构紧密,且最为稳定,不利于 Ba2+ 扩散至TiO2 中,从而导致四方性小。图 5(c)~(f)为 S1~S4 在煅烧温度为 1100 °C 时合成BaTiO3 粉体的 FESEM 图。由图可知,在相同煅烧温度下,S1 合成的 BaTiO3 粉体粒径最大,而 S3 和 S4 合成的 BaTiO3粉体粒径较小。
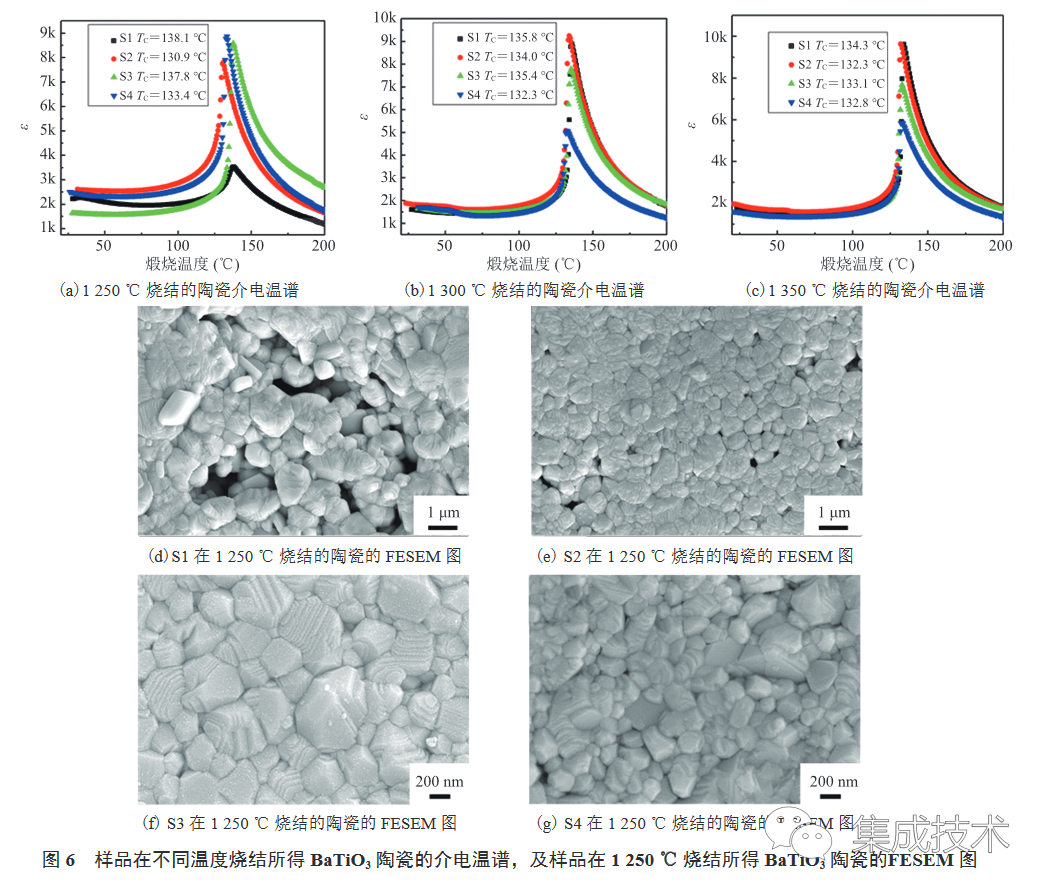
图 6(a)~(c)为样品在不同烧结温度下得到的 BaTiO3 陶瓷的介电温谱。由图 6(a)~(c)可知,S1~S4 都呈现出 BaTiO3 明显的相变峰,该峰表示 BaTiO3 陶瓷四方相→立方相的转化,其温度称为居里点(TC)。
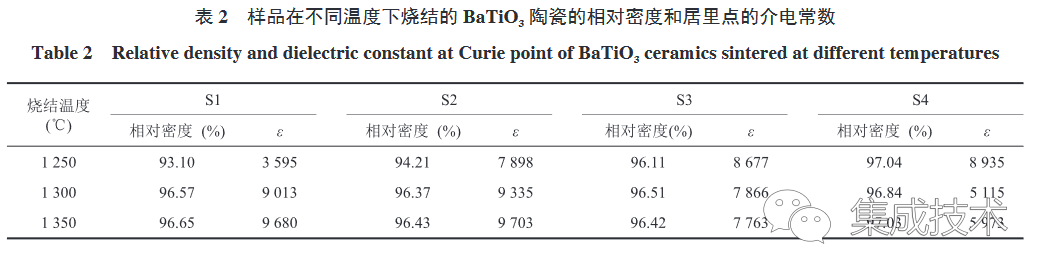
样品的相对密度和居里点所对应的介电常数如表 2 所示,随着烧结温度的升高,S1 和 S2 合成的 BaTiO3 陶瓷的相对密度和介电常数增大,而 S3 和 S4 的相对密度和介电常数基本保持不变,甚至还有部分减小。这是由于 S3 和 S4 的粉体粒径较小,烧结活性较高,在较低的温度(1250 °C)下即可烧结致密;而 S1 和 S2 的粒径较大,烧结活性较低,在较高的温度(>1300 °C)下才能烧结致密。当烧结温度为 1250 °C 时(图 6(a)),介电常数峰值满足关系:
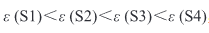
这与 Wang 等[40]提出的原始粉体颗粒的尺寸越大,烧结后介电常数越高的观点相悖。对比不同样品在 1250 °C 烧结后的 FESEM 图(图 6(d)~(g)),发现粉体颗粒尺寸大的 S1 和 S2 峰值低的原因是其低密度及高气孔率劣化了介电常数[41-42]。随着烧结温度的升高,S1 和 S2 逐渐致密,气孔率减少,介电常数峰值也显著升高,且高于 S3 与 S4。而 S3 与 S4 随着烧结温度升高,其密度基本不变但其介电峰值逐渐降低,这是由于晶粒增大而产生的更大应变,压低了介电峰[38]。
4 结 论
本文明确了利用砂磨工艺合成高四方性 BaTiO3超细粉体的最优参数,并阐明了砂磨固相合成高性能 BT 粉体的原理。通过相关性能测试,结果显示:直径较小的 ZrO2 砂磨介质细化 BaCO3 与TiO2 粒径的效率更高,能有效降低BaTiO3 BaTi 的煅烧温度,并抑制副产物 Ba2TiO4 的生成。在砂磨过程中,TiO2会发生锐钛矿相→TiO2-II 相→金红石相的转变。利用直径为0.1 mm 的 ZrO2 砂磨介质,采用较粗粒径的 TiO2(锐钛矿)和 BaCO3 在 1100 °C 煅烧 3 h,可得到平均粒径为 186 nm、四方性为 1.0092 的超细 BT 粉体,将该 BT 粉体于 1250 °C 烧结的陶瓷相对密度为 96.11%,居里点(137.8 °C)的介电常数峰值为 8 677。
//参考文献
(扫描下方二维码查看全文以及参考文献)





